Si jadis le collagène bovin pouvait corriger les cicatrices, il fallait qu’il en fût de même pour l’hyaluronane. Nous présentons ici notre expérience clinique, avec données histologiques, sur un petit nombre de sujets, dans le cadre du traitement des cicatrices qu’ils présentaient.
L’hyaluronane
L’hyaluronane, ou acide hyaluronique ou hyaluronate de sodium, est un composant naturel de la matrice extracellulaire. Composé de la répétition quasi infinie d’unités dis-sacchariques (N-acétylhexosamineβ (glucosamine ou galactosamine) et acide β-glucuronique, reliées par des liaisons 1-3 ou 1-4 glycosidiques), c’est une molécule polyanionique comportant une partie axiale hydrophobe et une partie équatoriale hydrophile. Sa masse moléculaire peut atteindre 6 MDaltons et plus. (1, 2, 3, 4)
La molécule est ubiquitaire et sans spécificité d’espèce ou d’organe dans sa forme native. D’une masse moléculaire moyenne de 350 KD (5) dans le derme, la molécule native est perpétuellement en mouvement, permettant ou non le passage des molécules nécessaires au métabolisme cellulaire, entre autres.
Il agit par l’intermédiaire de récepteurs spécifiques, entre autres, le CD44.
L’hyaluronane a différents rôles dans la matrice extracellulaire. Nous retiendrons :
- Lubrification des tissus, comme dans les articulations
- Hydratation des tissus, comme pour la peau
- Création de volume, comme dans l’oeil
- Intervention dans l’intégrité cellulaire, la migration, la prolifération et la différentiation cellulaire.
On sait que l’hyaluronane non réticulé peut entraîner, in vitro, la migration ainsi que la prolifération des fibroblastes. (5)
On sait aussi que l’hyaluronane réticulé peut stimuler la synthèse de collagène par les fibroblastes, très probablement par un effet de traction stimulateur sur ces derniers. (4)
Tout comme avec le collagène injectable, il est possible de tenter de traiter les cicatrices avec l’hyaluronane réticulé.
Matériel
Dans cet article, nous présentons nos observations suite à l’injection, dans des cicatrices chirurgicales ou traumatiques, d’un hyaluronane de comblement, bénéficiant de la technologie de réticulation CPM®. Le gel est dosé à 22.5mg/ml. L’hyaluronane utilisé est d’origine biotechnologique. L’agent réticulant est le BDDE.
Certains sujets ont bénéficié, pour des raisons de prudence, du même gel CPM®, mais plus faiblement réticulé et concentré (20.0 mg/ml).
La technique brevetée CPM® permet d’obtenir, au sein du gel monophasique, des zones plus réticulées et des zones moins réticulées. Il est donc polydensifié. Il a également des propriétés élastiques et cohésives remarquables.
La quantité de gel d’hyaluronane injectée fut de 0.1 ml à 0.25 ml maximum.
Sujets
Patient 1. homme, 50 ans, caucasien : Cicatrice nasale ancienne, post brûlure solaire sévère. (Basic)
Patient 2. homme, 36 ans, caucasien : Cicatrice traumatique frontale récente. (Soft)
Patient 3. femme, 60 ans, yéménite (mélanodermique) : Cicatrice chirurgicale ancienne de hernie cervicale à droite. (Basic)
Patient 4. femme, 35 ans, caucasienne : Cicatrice rhinoplastie. (Soft suivi de Basic)
Patient 5. femme, 66 ans, caucasienne : Cicatrice traumatique ancienne à la lèvre blanche supérieure et au sillon nasogénien gauche. (Basic)
Patient 6. femme, 52 ans, amérindienne, métissée : Cicatrice traumatique ancienne à la lèvre blanche supérieure droite. (Basic)
Méthode
La technique des multipunctures très rapprochées a été exclusivement utilisée dans la ou les cicatrices des sujets. Un blanchiment de la zone injectée a été obtenu lors des injections.
Aucune injection rétro-traçante n’a été pratiquée. Aucune surcorrection n’a été réalisée avec plutôt sous-correction que correction à 100%.
Le traitement s’est effectué en plusieurs séances, 2 voire 3, espacées d’un mois environ.
Histologie
On sait que :
Le gel à réticulation CPM® entraîne une image histologique très éloignée des amas dermiques profonds d’hyaluronane que l’on observe habituellement, que ce soit avec les gels biphasiques ou les gels monophasiques classiques. (8, 9, 10)
Avec la technologie CPM®, les parties les moins réticulées pourraient s’immiscer entre les fibres collagène et élastine présentes dans le derme, les parties les plus réticulées occupant les espaces les plus déshabités de ce dernier (8, 9), les plus dermatoporotiques®. (11)
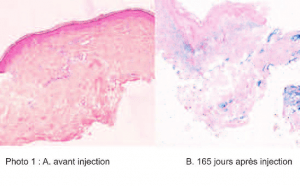 Histologie d’une cicatrice injectée partiellement avec le gel CPM® (photo 1 A-B)
Histologie d’une cicatrice injectée partiellement avec le gel CPM® (photo 1 A-B)
Zone non traitée (A) :
« Le derme, dépourvu d’annexe, est parcouru de petits capillaires, ponctués de rares lymphocytes épars. Le collagène dermique est discrètement homogénéisé, compatible avec un remaniement cicatriciel. » *
Zone traitée J 165 (B) :
« Le derme comporte de petits capillaires intacts et quelques lymphocytes épars. Le collagène est légèrement homogénéisé, compatible avec un remaniement cicatriciel. Dans le derme moyen et profond, présence d’un matériel exogène basophile amorphe, fortement coloré par le fer colloïdal, disposé sous forme de larges plages qui diffusent entre les travées collagènes, qui représentent 75% de la surface. Pas de réaction inflammatoire au contact de l’implant. Pas de granulome. »*
* Dr D. Sarazin- Laboratoire d’histopathologie Viollier-Weintraub, Genève-Suisse.
Résultats sur des cicatrices
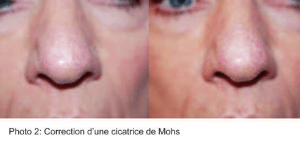
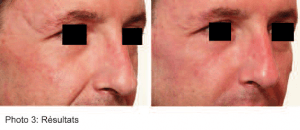
Nous avons pu observer dès la 1ère injection une nette amélioration de l’aspect clinique des lésions traitées. Après maximum 3 séances d’injection, à chaque fois avec de très petites quantités de gel, chaque patient, ainsi que le médecin injecteur ont estimé la correction optimale. (photos 2, 3)
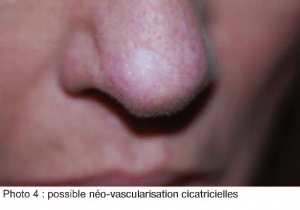
Il est intéressant de noter que, sur certaines cicatrices, comme celle de chirurgie de Mohs, on peut observer une néo-vascularisation depuis les berges cicatricielles. (Photo 4)
Les sujets présentant des cicatrices peu souples notent un assouplissement de ces dernières.
Effets secondaires
L’injection dans les cicatrices est, chez certains sujets et dans certaines zones, douloureuse, ceci malgré l’utilisation de crème anesthésiante.
Il semble y avoir une néo-angiogenèse au sein des cicatrices. Ce point devrait être précisé par des techniques contrôlées.
Nous n’avons pas mis en évidence de réaction inflammatoire prolongée, ni de granulome à corps étranger, avec un suivi de plus de 2 ans pour certains sujets.
Conclusion
Sur un petit nombre de patients, mais avec au moins un examen histologique, nous pouvons dire que l’injection de gel CPM®, Soft ou Basic, permet une correction optimale des cicatrices, tant récentes qu’anciennes. (photos 5 et 6)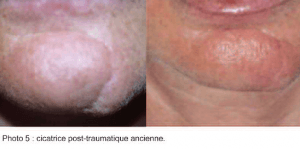 Le gel présente une parfaite bio-intégration, au sein du tissu cicatriciel, tout comme au sein d’un derme normal. (8, 9)
Le gel présente une parfaite bio-intégration, au sein du tissu cicatriciel, tout comme au sein d’un derme normal. (8, 9)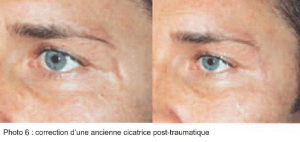 Il semble y avoir une néo-vascularisation de la zone traitée, comme par exemple dans une cicatrice de greffe cutanée post chirurgie de Mohs, ou de rhinoplastie.
Il semble y avoir une néo-vascularisation de la zone traitée, comme par exemple dans une cicatrice de greffe cutanée post chirurgie de Mohs, ou de rhinoplastie.
Bibliographie
1. Web site : http//www.glycoforum.gr.jp/science/hyaluronan/HA21/HA21E.html
2. Navsaria H. : “L’acide hyaluronique, matériel biotechnologique.”Ann Derm Venereol, 2002; 129 : 1227-1230.
3. Bonnetblanc JM. : “Propriétés pharmacologiques de l’acide hyaluronique. » Ann Dermatol Venereol 2001 ; Suppl : 9-12
4. Wang F., Graza L.A., et al : « In vivo stimulation of de novo collagen production caused by cross-linked hyaluronic acid dermal filler injections in photo-damaged human skin. » Arch Dermatol. Feb 2007; Vol 143 : 155-163.
5. Documents IDUNE. Centre de thérapie cellulaire-Laboratoire Genévrier présentation au DU des Injectables en Dermatologie, Angéiologie et Chirurgie Plastique, Hôpital Tarnier-Cochin, Université Paris V. Janvier 2008.
6. Micheels P. : «Les gels d’hyaluronane injectables en esthétique. » J. Méd. Esth. et Chir.Derm. Septembre 2006, Vol XXXIII; N°131 : 157-162.
7. Micheels P., Sarazin D., J-L. Salamin : « Examens comparatifs des hyaluronanes. » J. Méd. Esth. et Chir. Dermatol. Mars 2008, Vol XXXV ; N° 137 : 17-29.
8. Reinmüller J. : « Neue generation von hyaluronsäurefillern. Bessere verteilung in der haut dank CPM-verfahren. », Aesthetic TRIBUNE September 2005; 4.
9. Bezzola A., Micheels P. : « Esthélis®, acide hyaluronique de conception suisse. Première étude complète des caractéristiques physico-chimiques et essais cliniques. » J. Méd. Esth. et Chir. Dermatol. Mars 2005, Vol XXXII, 125.
10. Salomon D., Kaya G, Tran, Ch. : « Comparative histological and biochemical study of different hyaluronic acid fillers. » en cours de publication.
11. Kaya G., Saurat J-H. : « Dermatoporosis : a chronic cutaneous insufficiency/fragility syndrome. » Dermatology 2007 ; 215 :
-
Note du comité de lecture