L’ultrasonographie est un outil couramment utilisé dans de nombreuses spécialités en médecine.
En médecine vasculaire, par exemple, il est évident d’injecter sous contrôle échographique, une veine variqueuse que l’on veut scléroser. De même, les traitements endoveineux thermiques sont réalisés sous contrôle échographique : cela permet de diriger le geste de façon sûre et d’optimiser le résultat.
En médecine esthétique, les injections d’acide hyaluronique ou d’autres produits résorbables ou semi résorbables sont devenues une pratique courante. Cependant, comme pour toute intervention médicale, il est essentiel de minimiser les risques associés pour assurer la sécurité et le bien-être du patient. L’écho-doppler cutané peut se révéler intéressant dans ce cadre.
Echographie cutanée et l’effet Doppler
L’échographie est une technique d’imagerie utilisant des ultrasons. Comme le son, les ultrasons constituent des vibrations mécaniques transmises dans la matière. Les ultrasons traversent les milieux biologiques. Il s’agit de mouvements oscillatoires se propageant sous forme d’une onde (Figure 1). En médecine, les fréquences utilisées sont généralement comprises entre 2 et 15 MHz. En échographie cutanée les fréquences utilisées peuvent aller jusqu’à 50 MHz. On parle alors d’Ultrasound BioMicroscopie, UBM (1) – pour mémoire, l’oreille humaine peut percevoir des sons jusqu’à 20 KHz.
Les sondes à larges bandes offrent souvent sur une même sonde une plage de fréquences de 6 à 20 MHz et avec un logiciel de reconstruction de tirs multiples (angulation du faisceau d’ultrasons) permettent une analyse sémiologique extrêmement fine et précise des couches cutanées.
Les ultrasons sont générés par une sonde comportant un transducteur. Lorsque ce transducteur reçoit une impulsion électrique, il génère une impulsion mécanique (vibration), c’est une impulsion acoustique ultrasonore. Le transducteur émet les ultrasons sous la forme d’un faisceau de diamètre variable. Les impulsions ultrasonores sont réfléchies par les structures anatomiques (interfaces) réfléchissantes, d’impédances acoustiques différentes suivant les tissus, vers le récepteur placé dans la même sonde émettrice. Les échos enregistrés, traités par un logiciel, montrent les obstacles rencontrés par le signal. La mesure de l’amplitude du signal reçu permet de distinguer un tissu mou (muscles) d’un tissu dur (les os), le temps de retour de l’onde réfléchie est proportionnel à la distance séparant l’émetteur ultrasonore de la structure échogène (2).
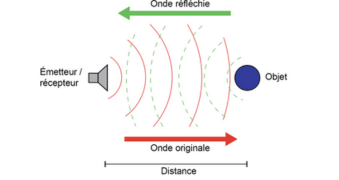
Figure 1. Principe de l’échographie
Les ultrasons sont atténués dans les milieux qu’ils traversent en proportion de la distance parcourue, mais aussi en fonction de leur fréquence (Tableau 1). Les hautes fréquences permettent une exploration des tissus et organes superficiels avec une bonne résolution spatiale, tandis que les basses fréquences permettent une exploration plus en profondeur avec une moins bonne résolution spatiale.
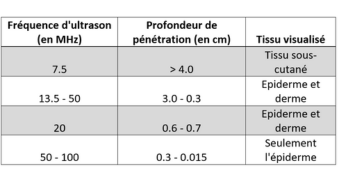
Tableau 1. Profondeur de pénétration et tissus observés pour chaque fréquence d’ultrason (d’après le tableau de Bhatta, Keyal & Liu 2018 (1)).
Si l’on représente l’amplitude des échos par la brillance d’un point, on réalise une échographie en mode B (B = brillance). Ainsi, les interfaces peu échogènes se signalent par des points de faible brillance : noir (anéchogène), gris sombre (hypo-échogène), tandis que les interfaces plus échogènes se signalent par des points de forte brillance : gris clair (iso-échogène, se fondant avec les structures avoisinantes), blanc (hyper-échogène).
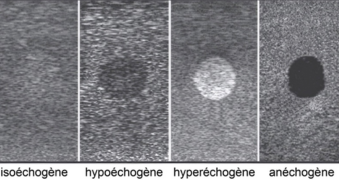
Figure 2. Types d’échogénicité (Figure adaptée de Hee-Jin Kim et al. (3))
L’échographie, couplée au Doppler pulsé couleur, permet une bien meilleure visualisation des vaisseaux. L’effet Doppler est un phénomène physique s’appliquant universellement aux ondes et est utilisé pour l’exploration vasculaire. La réflexion des ultrasons se fait vers le récepteur selon une fréquence proportionnelle à la vitesse du sang et à l’angle d’incidence du faisceau d’ultrasons sur le vaisseau. Le Doppler pulsé permet de sélectionner une zone dans laquelle le signal Doppler est recueilli et le codage de ce signal en couleur permet de visualiser les vaisseaux (2).
Quelles sont les applications possibles en médecine esthétique ?
Echographie cutanée pré procédure
Repérage de pathologie cutanée
En médecine esthétique, ce point n’est pas central; néanmoins, des lésions cutanées peuvent être facilement explorées.
Lipome : Ovalaire, siège hypodermique, parfois encapsulé, iso-échogène et homogène, travées horizontales, compressible, pas de signal Doppler (4).
Kyste épidermoïde : Ovalaire, contours réguliers, contenu souvent hétérogène, renforcement postérieur, pas de flux Doppler (3).
Kyste trichilemmal : Hétérogène, plages hypo-échogènes, renforcement postérieur, pas de flux Doppler.
Pilomatricome : Hétérogène, spots hyper-échogènes correspondant à des calcifications, contour hypoéchogène, légèrement vascularisé au Doppler couleur.
Sclérodermie : Augmentation de l’épaisseur de la peau, œdèmes aux stades précoces; peut permettre un diagnostic précoce, permet la mesure du derme et le suivi thérapeutique (5).
Cicatrice chéloïde : Récente : hypo-échogène; ancienne : échogène, mesure de l’épaisseur du derme, visualisation de corps étranger, permet le suivi thérapeutique.
D’autres lésions sont ainsi explorables avec leurs spécificités : histiocytofibrome, angiomes, hémangiomes, lipœdème , lymphœdème, etc.
Repérage des différentes couches de la peau
En échographie cutanée, la couche épidermique est hyper-échogène ; le derme est moyennement échogène, la couche graisseuse sous-cutanée est hypo-échogène et le fascia musculaire apparaît comme une ligne de démarcation hyper-échogène longitudinale.
Les structures osseuses sont également hyper-échogènes. Les images échographiques permettent non seulement d’obtenir la structure des couches cutanées, mais aussi d’en déterminer l’épaisseur et la densité (1).
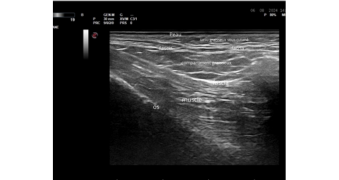
Figure 3. Echographie de la région temporale.
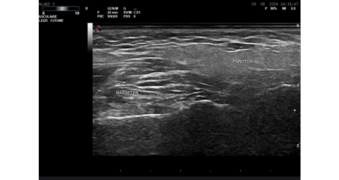
Figure 4. Echographie de la parotide et muscle masseter.
Repérage de produit de comblement préexistant
Les patient(e)s déjà injecté(e)s ne se souviennent pas toujours du type ni de la localisation des produits injectés. Grâce à l’échographie, il est possible de visualiser précisément la localisation, la migration des produits, ainsi que leur nature. Par exemple, l’acide poly lactique donne des patchs hyperéchogènes. Le poly méthyl méthacrylate, quant à lui, produit des images en queue de comète, assez caractéristiques.

Figure 5. Rendu échographique de différents types de fillers injectés (Images empruntées à Beiu et al. 2023 (6))
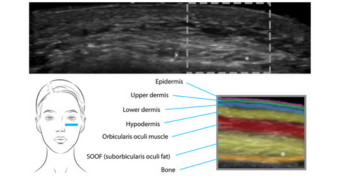
Figure 6. Structures pseudo kystiques d’AH de haute densité placées près du périoste dans la zone de la vallée des larmes (Images empruntées à Beiu et al. 2023 (6))
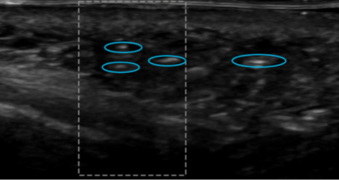
Figure 7. PLLA a été injecté il y a 7 mois dans les joues. L’échographie montre des taches hyperéchogènes (cercles bleus) dans le derme inférieur et l’hypoderme, ce qui donne un aspect marbré diffus (Images empruntées à Beiu et al. 2023 (6))
![]()
Figure 8. Injection d’huile de silicone dans la lèvre inférieure, visible à l’échographie sous forme de dépôts bien définis, hyper-échogènes et ressemblant à une masse, qui produisent une réverbération postérieure diffuse (« image de tempête de neige »).
(Images empruntées à Beiu et al. 2023 (6))
Cartographie vasculaire
Les techniques d’injection sont maintenant bien codifiées; cependant, cette cartographie peut être utilisée pour des zones présentant une densité importante du réseau artériel ou des zones à risque, comme le nez, les tempes et les lèvres, en raison de la grande variabilité anatomique de la distribution vasculaire de l’artère faciale (7).
En cas de pose de fils tenseurs, la cartographie vasculaire permet d’éviter de toucher un vaisseau avant la mise en place des fils.
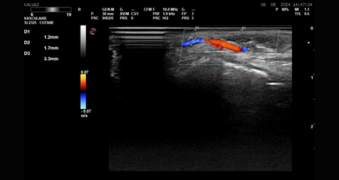
Figure 9. Echographie de l’artère faciale au niveau du sillon nasogénien.
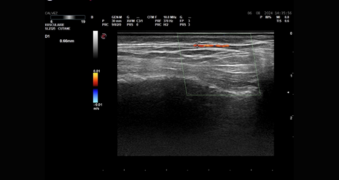
Figure 10. Echographie de l’artère temporale superficielle.
Echographie doppler per procédure
Cette technique permet une injection dans le bon plan de manière sûre, avec une très bonne visualisation en direct des vaisseaux ainsi que de l’aiguille, dont le positionnement peut être modifié de façon précise.
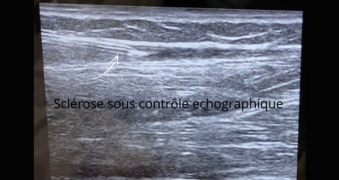
Figure 11. Exemple de visualisation par échographie de l’aiguille introduite dans un vaisseau. On note des artefacts de réverbération (série d’échos linéaires réfléchis en profondeur par rapport à l’aiguille).
Echographie post procédure
On peut visualiser le produit injecté en post procédure immédiate et à distance.
- Visualisation des complications vasculaires avec image en mosaïque d’une sténose.
- Visualisation de nodule, masse palpable au niveau du site d’injection; délai d’apparition court; structure anéchogène, bien limitée sans augmentation de la vascularisation.
- Visualisation de granulome, réaction inflammatoire à un corps étranger; délai de quelques mois ou quelques années; masse hypo-échogène, contours irréguliers, mal limitée avec hypervascularisation.
- Infection : collection liquidienne, uni ou multiloculaire, avec vascularisation périphérique.
Conclusion
L’écho Doppler est une technique fiable et reproductible. La maîtrise de cette méthode implique une courbe d’apprentissage; idéalement, une exploration par jour est recommandée, ce qui peut initialement augmenter la durée des consultations. De plus, il est nécessaire de prévoir un espace supplémentaire dans le cabinet médical pour accommoder l’équipement. Cependant, les échographes sont de plus en plus compacts, les sondes deviennent plus petites et plus maniables et le coût du matériel diminue. Grâce à cet outil, il n’est plus nécessaire de travailler à l’aveugle, ce qui réduit la crainte de causer des dommages.
Bibliographie
- A.K. Bhatta, U.Keyal, and Y.Liu, « Application of High Frequency Ultrasound in Dermatology, » Discovery Medicine, vol. 26, no.145, pp. 237-242, Dec. 2018.
- (SFMV) Société Française de Médecine Vasculaire, (CEMV) Collège des enseignants de médecine vasc, (CFPV) Collège Français de Pathologie Vasculaire and Constans, Joël, Les explorations vasculaires. Elsevier Masson, 2014.
- H.K.Kim, S.M.Kim, S.H.Lee, J.M. Racadio, and M.J.Shin, « Subcutaneous epidermal inclusion cysts: Ultrasound (US) and MR imaging findings, « Skeletal Radiol, vol.40, no.11, pp. 1415-1419, Nov. 2011, doi: 10.1007/s00256-010-1072-4.
- Y.S.Shin et al., « Sonographic Differentiation Between Angiolipomas and Superficial Lipomas, « Journal of Ultrasound in Medicine, vol. 35, no.11, pp.2421-2429, 2016, doi:10.7863/ultra.15.08050.
- M.Dzwigala, P.Sobolewski, M.Maslinska, I.Yurtsever, E.Szymanska, and I.Walecka, « High-resolution ultrasound imaging of skin involvement in systemic sclerosis: a systematic review, » Rheumatol Int, vol.41, no.2, pp.285-295, Feb.2021, doi: 10.1007/s00296-020-04761-8.
- C.Beiu et al., « Personalization of Minimally-Invasive Aesthetic Procedures with the Use of Ultrasound Compared to Alternative Imaging Modalities, » Diagnostics, vol.13, no.23, Art.no.23, Jan.2023, doi: 10.3390/diagnostics13233512.
- Gaudy, Jean-François and Vacher, Christian, Atlas d’anatomie clinique et chirurgicale des tissus superficiels de la tête et du cou. Elsevier Masson, 2010.
- L.W. Schelke, P.Velthuis, J.Kadouch, and A.Swift, « Early ultrasound for diagnosis and treatment of vascular adverse events with hyaluronic acid fillers, » Journal of the American Academy of Dermatology, vol.88, no.1, pp.79-85, Jan.2023, doi: 10.1016/j.jaad;2019.07.032.




4 commentaires
comment réduire calibre des grosses veines comme des vers de terre sur les mains?
bcq de femmes complément sur ce problème esthétique…et qui « défiguré » les mains…
pourquoi les phlébologue angio ne font rien
Bonjour, les veines des mains sont essentielles pour assurer le retour veineux, les scléroser peut entrainer des complications comme par exemple des phlébites. Par ailleurs le résultat esthétique n’est pas satisfaisant.
Cordialement.
merci dr je comprends .j’ai vu qu’il existait des micro-phlebectomie .
les résultats sont très bien mais sous les photos aucune n’indiquent le praticien .comment en trouver un?
Merci cdlt
Bonjour Elisa,
Pour trouver un praticien dans votre ville/région, vous pouvez utiliser notre outil de mise en relation : https://www.afme.org/trouver-medecin-esthetique-region/
Bien à vous.