Le concept de biofilms est relativement nouveau en dermatologie. Ils n’ont été que peu étudiés dans ce domaine, à en juger par le faible nombre de publications consacrées au sujet. Récemment, il a pris de l’importance, car il semble être souvent rencontré lors de complications chez les patients qui ont reçu des implants de remplissage a visée esthétique, parmi eux, l’acide hyaluronique est le plus couramment utilisé.L’attrait pour ces produits peut être attribué en partie à leurs profils de grande sécurité. Néanmoins, des complications peuvent parfois survenir. Bien qu’elles soient rares, il est nécessaire de les connaître afin d’être préparé à leur gestion. Les évènements indésirables, tels que sensibilité, douleur et ecchymoses peuvent en partie être causées par une mauvaise technique d’injection. De même, les bosses, nodules, surcorrections, migration et effet Tyndall peuvent être observés plus fréquemment si l’injecteur est moins expérimenté. D’autres complications plus ennuyeuses, telles que réactions allergiques, granulomes, réactivation d’infections herpétiques, biofilms, infections aigües, paralysies des nerfs et complications sont imprévisibles, mais des mesures peuvent être prises pour réduire leur survenue.
Objectif
Définir à l’appui d’une revue de la littérature récente, le rôle de biofilms, lors des complications consécutives à des injections de produits de comblement a visé esthétique. Des rapports récents suggèrent que leur développement peut être une cause sous-jacente de ces complications rares. Bien que plus souvent associés à des fillers semi-résorbables, les biofilms peuvent être vus avec presque tous les injectables. Ainsi, il apparaît intéressant de définir les complications associées aux agents de remplissage dermique disponibles, de connaître les stratégies pour les éviter et les options de gestion si elles surviennent afin d’optimiser l’utilisation de ces produits utilisés à visée esthétique.
Définition
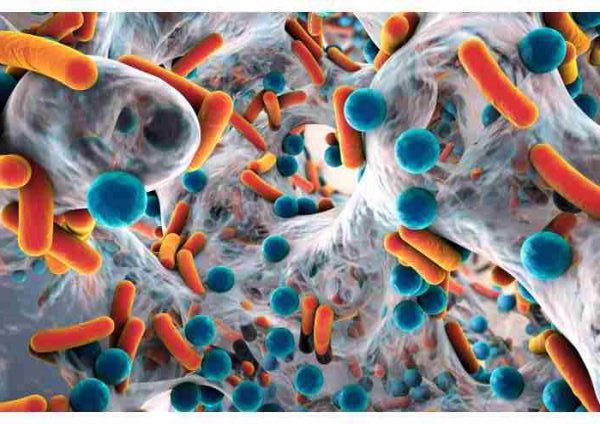
Un biofilm est une communauté de microorganismes (bactéries, champignons, etc.) agrégés en micro-colonies adhérant à une surface inerte ou biologique, caractérisée par la sécrétion d’une matrice adhésive et protectrice d’exopolymères (EPS).
Ces surfaces peuvent être fournies par des dispositifs artificiels tels que les prothèses valvulaires et les implants mammaires ou dans des situations dermatologiques comme avec les fillers. Ils représentent une forme de vie existant depuis au moins 3,3M d’années. Les premières observations de biofilms ont été faites sur la plaque dentaire par Anthony Van Leeuwenhoek, qui a souligné la capacité limitée de tuer les micro-organismes adhérents à ses dents. Puis ils ont été évoqués par Costerton, bactériologiste, en 1978, mais leur visualisation n’était pas possible jusqu’à l’utilisation du microscope électronique à balayage.
Leur architecture constitue un défi pour les cliniciens, car les techniques de culture de routine ne permettent pas leur mise en évidence. C’est la microscopie à épifluorescence (PNA FISH) qui a été en mesure de démontrer la présence de bactéries dans des situations où les cultures bactériennes étaient négatives.
Ces biofilms sont omniprésents et se retrouvent dans les cours d’eau, les tuyaux corrodés, les douches, les comptoirs et les usines de traitement des égouts… En médecine, les biofilms ont été associés à des infections des voies urinaires, endocardites, otite moyenne, maladie biliaire, ostéotomes et a tous les implants chirurgicaux. Ils ont été associés a 80% de toutes les infections de l’homme.
Le processus de formation des biofilms
Les biofilms peuvent contenir de nombreux types de micro-organismes, bactéries, protozoaires et champignons, mais un modèle colonisé par Pseudomonas aeruginosa a été largement étudié car dans la mucoviscidose, les biofilms de Pseudomonas aeruginosa existent dans les poumons à des concentrations normalement mortelles.
La formation d’un biofilm commence par la fixation d’une bactérie, la concentration et l’attachement de bactéries, formant une colonie flottant librement autour d’un foyer infectieux. Les bactéries se retrouvent piégées avec des cellules (leucocytes) dans les EPS (matrices d’exopolymères), formant des microcolonies.
...La suite de ce contenu est réservée aux membres de l'AFME.
Pour voir l'article en entier, connectez-vous >
-
Note du comité de lecture